Perubahan Energi Dalam Sistem ΔU Termodinamika Fisika
Hukum I Termodinamika menjelaskan bahwa apabila sejumlah kalor mengenai suatu sistem dan digunakan oleh sistem untuk melakukan usaha, maka selisih energi dan usaha merupakan perubahan energi dalamnya.
Sehingga secara matematis dapat dirumuskan menjadi:
ΔU = Q - W atau Q = ΔU + WSehingga secara matematis dapat dirumuskan menjadi:
Aturan tanda positif dan negatif pada:
a. Usaha atau Kerja (W)
W (+) jika sistem melakukan usaha atau usaha dilakukan oleh sistem
W (-) jika sistem dikenai usaha / sistem menerima usaha/ usaha dilakukan pada sistem
b. Kalor atau Panas (Q)
Q (+) jika sistem memperoleh kalor/ sistem menerima kalor
Q (-) jika sistem melepaskan kalor/ sistem kehilangan kalor
c. Energi Dalam Gas Ideal (ΔU)
Energi dalam merupakan energi yang dimiliki oleh tiap molekul sebagai ukuran sistemnya atas kepemilikan suhu dan tekanan.
c.1. Energi dalam ΔU pada gas monoatomik, contohnya Ar, He, dan Ne.
ΔU = 3/2 N.k.(T2-T1) = 3/2 n.R.(T2-T1)
c.2. Energi dalam ΔU pada gas diatomik dibedakan menjadi 3 tergantung dari suhu yang mempengaruhi derajat kebebasan yang dimiliki oleh gas. Contoh gas diatomik seperti O2, H2, dan N2.
c.2.1. Gas diatomik pada suhu rendah sebesar ±250 K.
ΔU = 3/2 N.k.(T2-T1) = 3/2 n.R.(T2-T1)
c.2.2. Gas diatomik pada suhu sedang sebesar ±500 K.
ΔU = 5/2 N.k.(T2-T1) = 5/2 n.R.(T2-T1)
c.2.3. Gas diatomik pada suhu tinggi sebesar ±1.000 K.
ΔU = 7/2 N.k.(T2-T1) = 7/2 n.R.(T2-T1)
Soal dan Pembahasan Energi Dalam (ΔU)
1. Dalam suatu sistem menerima usaha sebesar 3.500 Joule, setelah sistem tersebut menyerap kalor sebesar 5.000 J. Perubahan energi dalam sistem tersebut sebesar ...
Pembahasan:W = - 3.500 J
Q = + 5.000 J
Perubahan energi dalam sistem:
Q = ΔU + W
5.000 = ΔU + (-3.500)
5.000 + 3.500 = ΔU
8.500 J = ΔU
2. Suatu sistem menyerap panas sebesar 2.100 Joule dan sistem melakukan kerja/ usaha sebesar 600 Joule. Perubahan energi dalam sistem tersebut sebesar ...
Pembahasan:W = + 600 J
Q = + 2.100 J
Perubahan energi dalam sistem:
Q = ΔU + W
2.100 = ΔU + 600
2.100 - 600 = ΔU
1.500 J = ΔU
3. Sebuah sistem mengalami proses adiabatik. Pada sistem tersebut dilakukan usaha sebesar 100 J dan perubahan energi dalam sistem sebesar ΔU serta kalor yang diserap sistem sebesar Q, maka ...
Pembahasan:
Pembahasan:W = - 100 J
Q = 0 J (proses adiabatik)
Perubahan energi dalam sistem:
Q = ΔU + W
0 = ΔU + (-100)
0 + 100 = ΔU
100 J = ΔU
4. Suatu keadaan dimana 2 mol gas ideal monoatomik memiliki suhu awal 27°C kemudian dinaikkan menjadi 127°C pada tekanan tetap. Besar perubahan energi dalam yang dilakukan gas ideal tersebut sebesar ...
Pembahasan:
n = 2 mol
T1 = 27°C = 300 K
T2 = 127°C = 400 K
R = 8,314
Perubahan energi dalam sistem:
ΔU = 3/2.n.R.(T2-T1)
ΔU = 3/2.2.8,314.(400-300)
ΔU = 2.493 Joule
5. Sebuah tabung berisi 1 kg gas nitrogen dengan suhu awal sebesar 12°C dinaikkan menjadi 92°C melalui proses isobarik. Perubahan energi dalam yang dialami gas nitrogen pada tabung sebesar ...
Pembahasan:
n = m/Mr = 1000 gr/28 mol
T1 = 12°C = 285 K
T2 = 92°C = 365 K
R = 8,314
Perubahan energi dalam sistem:
ΔU = 3/2.n.R.(T2-T1)
ΔU = 3/2.(1000/28).8,314.(365-285)
ΔU = 35.631 J = 3,6 x 10^4 Joule
6. Dua mol gas diatomik memiliki energi kinetik sebesar 7 x 10^-20 Joule. Hitunglah jumlah molekul gas diatomik dan energi dalamnya?
Pembahasan:
n = 2 mol
Ek = 7 x 10^-20 J
NA = 6,02 x 10^24 molekul
Jumlah molekul gas diatomik sebanyak:
N = n.NA = 2 . 6,02 x 10^24
N = 1,204 x 10^24 molekul.
Energi dalam pada gas diatomik:
ΔU = N.Ek
ΔU = (1,204 x 10^24).(7 x 10^-20)
ΔU = 8,428 x 10^4 Joule
ΔU = 84,28 kJ
6. Dua mol gas diatomik memiliki energi kinetik sebesar 7 x 10^-20 Joule. Hitunglah jumlah molekul gas diatomik dan energi dalamnya?
Pembahasan:
n = 2 mol
Ek = 7 x 10^-20 J
NA = 6,02 x 10^24 molekul
Jumlah molekul gas diatomik sebanyak:
N = n.NA = 2 . 6,02 x 10^24
N = 1,204 x 10^24 molekul.
Energi dalam pada gas diatomik:
ΔU = N.Ek
ΔU = (1,204 x 10^24).(7 x 10^-20)
ΔU = 8,428 x 10^4 Joule
ΔU = 84,28 kJ
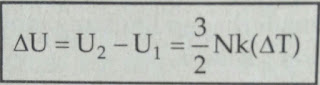




Comments
Post a Comment